理大科研成果革新醫護療程
理大三項醫療方面的創新技術,於「2020 TechConnect商業網上峰會暨展覽」中勇奪「全球創新獎」。 PolyUStimulator 是首個無需配置電池、用以刺激神經的儀器,與傳統的神經刺激器有相同效果;而人工智能膝骨關節炎預測系統,能協助醫護人員制訂切合患者個人情況的治療方案;此外,接觸紫外光後會發出熒光的新型納米粒子,有助改進肝癌及糖尿病等疾病的治療。這些科研成果皆具龐大潛力,能為病人帶來裨益。
PolyUStimulator — 強力新型醫療器材(無需植入電池)
對於罹患神經系統損傷(例如脊椎受傷或慢性痛症)的病者來說,將神經刺激器植入體內,有望恢復活動能力,或毋須用藥而紓緩痛楚;然而,這類以電力發動的儀器仍有不少限制。
現時大部分的植入式神經刺激器均依賴內置電池供電,因此壽命亦較短。此外,神經刺激器必須藉著手術植入體內。尤其令人關注的是,這些儀器的內置電池或會在人體內漏電。
針對上述問題,理大生物醫學工程學系助理教授 ( 研究)Monzurul Alam 博士及梁顯利生物醫學工程 ( 研究)教授鄭永平教授致力尋找解決方案。他們研發了名為PolyUStimulator的另類植入刺激器。據他們解釋,這名字是將理大(PolyU)中的「U」與刺激器(Stimulator)中的「S」結合,以代表這款新儀器的能量是從超聲波(ultrasound)而來。
小巧、安全、簡單
PolyUStimulator 植入器從超聲波提取能量,超聲波可經皮膚傳入體內,再轉化為壓電刺激電流,而這植入儀器可在毋須配置電線或內置電池的情況下運作。儀器植入體內之後,只要在皮膚表面啟動超聲波探頭,即可造成電流刺激。
「這是個十分簡單的儀器。」鄭教授稱:「源自超聲波的能量屬交流電,經由儀器將之轉化為適用於以電力刺激神經的脈衝電流。儀器巧妙之處在於極微小,甚至可以用注射方式植入體內,毋須進行手術。」
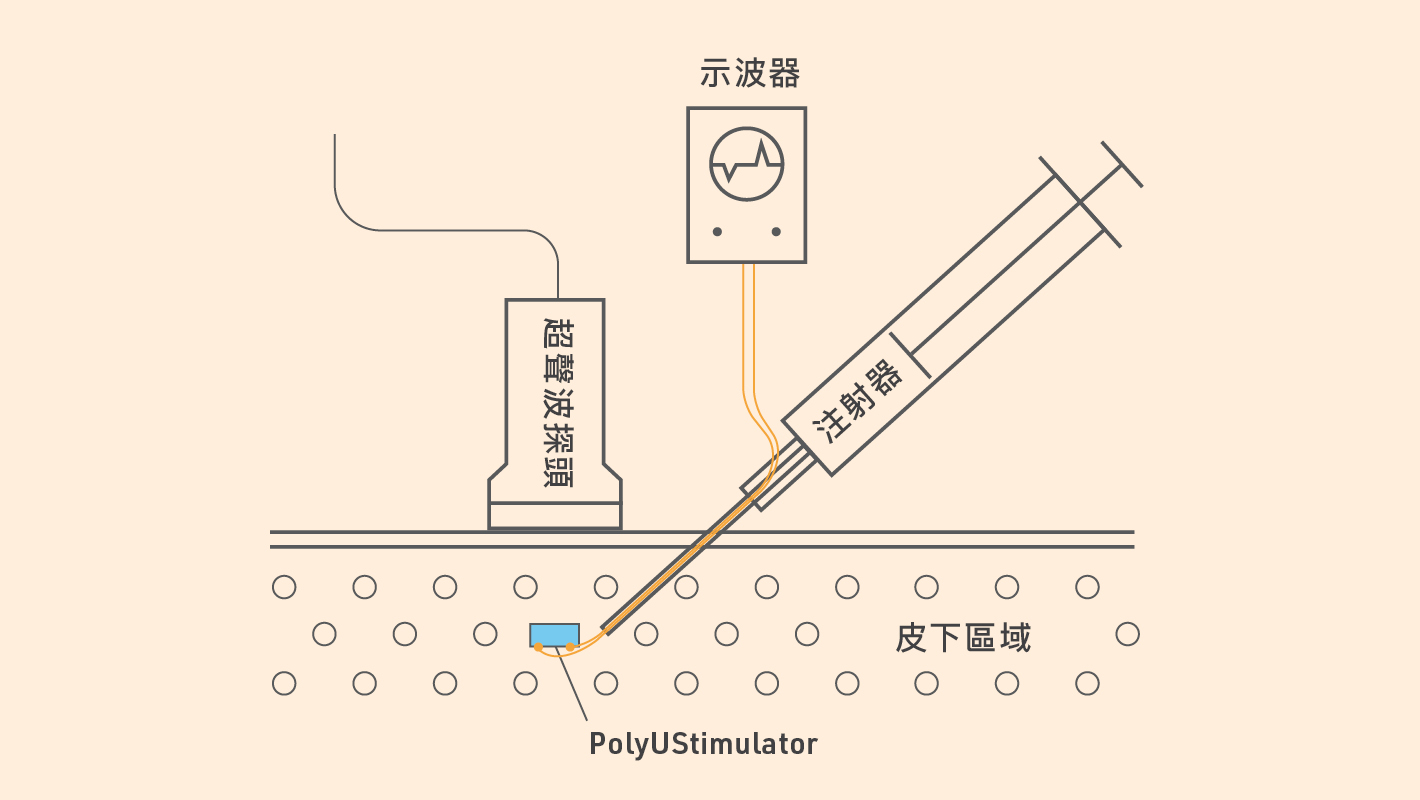
PolyUStimulator可以小至直徑一毫米,細小得足以安全地以注射方法植入皮膚下。
超聲波的優點在於能深入傳統電感能量難以安全觸及的人體深處,而且不受射頻干擾。再者,儀器產生的刺激可由外置超聲波來源控制及調節,甚至調校至不同超聲波頻率,通過多個模組用於多個刺激通道。由於此儀器微小而且與人體組織相容,理論上可以持續運作。
儘管現時尚未進行人體試驗,但動物測試已證明了該刺激器的功效。
專門研究脊椎損傷的 Alam 博士說:「我們從動物體外將能量傳送到連接肌肉的植入器。當電流向肌肉發出脈衝,肌肉就會收縮而使腿部活動,情況與現時治療癱瘓病人的植入功能性電流刺激相似。」

Monzurul Alam博士(左)與鄭永平教授
邁出下一步
雖然PolyUStimulator仍在初步開發階段,但它極具潛力,可用作治療脊椎受損、神經性痛症,以及多重骨折的病人。
為進一步完善該刺激器,Alam博士與鄭教授仍需物色合適的表層物料以防人體排斥,以及將刺激器固定在所選位置的最佳方法。
儘管如此,PolyUStimulator 已獲期刊《生物電子醫學》(Bioelectronic Medicine)評為首個無需配置電池而能與傳統電刺激器有相同效果的神經刺激器。
~~~
人工智能膝骨關節炎預測系統
膝骨關節炎如能儘早發現,不但有助控制病情,亦能減低需要更換人造關節的機會。為促進治療成效,生物醫學工程學系哲學碩士學生李浩軒及陳樂晉在溫春毅博士指導下,研發出「基於機器學習的膝骨關節炎惡化時序預測系統」。

(左起)陳樂晉、溫春毅博士與李浩軒
這套人工智能系統藉著分析醫學數據,包括健康電子記錄表及膝骨射線影像,預測膝骨關節炎惡化的風險,準確度達到八成以上,能讓醫療人員有效地為患者進行分流及制訂合適的治療方案。研究團隊亦正開發手機應用程式,讓患者可定期計量及記錄相關的生理數據,方便持續跟進和自我管理病情。
李浩軒表示:「我希望這套人工智能預測系統日後能成為預防性醫療設施,而利用人工智能輔助管理慢性疾病,亦能擴展至其他肌肉骨骼疾病及年老相關的疾病,例如骨質疏鬆症、阿茲海默症、心臟病及中風。」
~~~
突破性納米載體可用於藥物和基因治療
納米載體是極微小的納米粒子,用於把藥物或基因傳送到人體內一般難以觸及的位置。然而,此技術仍有待改良。要將藥物傳送到人體預定區域仍具挑戰,而在納米載體注入病人體內以後要追蹤其位置亦頗有難度。
理大應用生物及化學科技學系李蓓教授已成功為首項挑戰找出解決方案。李教授及其團隊研發出創新的兩親核-殼納米載體,能快速和準確地將基因傳送到細胞內。
「要將基因傳送到細胞是極其困難的事,因為基因是十分脆弱的分子,很容易便會降解。」李教授稱:「我們成功製造出雙層結構的納米載體,能將基因包裹在其表層,並且保護基因免在人體內移動時被降解,而當載體進入細胞後,保護層便會打開,把基因釋放出來。」
李教授補充說,她研發的納米載體已成功在肝癌和糖尿病的胰島素阻抗治療中傳送基因。

(上)李蓓教授在納米載體領域及治療癌症等疾病方面取得進展。
(左)當接觸到紫外光時,右邊兩支含有納米粒子的溶液即發出熒光。
追蹤納米粒子
至於第二項挑戰,即追蹤在體內的納米載體,李教授數年前在三藩市一個展覽中被問及這個問題。當時一間大型藥廠對李教授的研究極感興趣,但存顧慮。「他們想知道這些納米粒子在注入體內之後往哪裏去。」
這個問題十分重要,因為必須確定這些粒子在治療期間到底是留在體內,還是已隨著排洩物排出體外。這個問題啟發了李教授研發出新型的納米粒子,這些粒子在接觸紫外光後會發出熒光。
這項發明開拓了一系列契機,包括在生物醫學範疇的應用,例如體外細胞成像生物標記、影像引導治療、診斷成像,以及化學感應器等。它還可應用在非醫學範疇,包括防偽熒光墨料,以及能令油漆對紫外光作出反應的「智能塗層」。
雖然李教授的光致發光納米粒子仍有待進一步研發,才能進行技術授權,但她已成功在短時間內取得一項美國專利,這令她對納米粒子的潛力充滿信心。
~~~
上述三項新技術均在「2020 TechConnect商業網上峰會暨展覽」奪得「全球創新獎」。TechConnect在美國波士頓舉行,是全球最具規模的跨業界科研盛事,旨在推動創新技術的研發及商品化。「全球創新獎」根據所提交技術對業界所產生的潛在正面影響,頒授予最優秀的15%參選項目。在2020年共有超過400個項目參選,包括來自世界頂尖大學與科技企業的參選項目。








