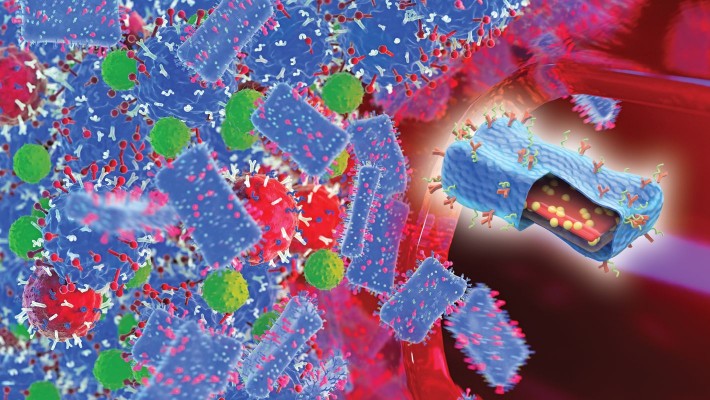
仿生纳米片促进协同治疗和多模态成像以抗击癌症
理大研究人员模仿生物化学过程,研发出新型纳米片,用以治疗癌症
理大常务及学务副校长及化学科技讲座教授黄永德教授带领应用生物及化学科技学系的科研团队,研发出新型仿生纳米片。这项突破首次结合两种新兴的治疗癌症 方法(免疫疗法和光热治疗)与三种成像模态(核磁共振成像、光声成像和光热成像)。
该新型的二维纳米片以铁磷硒(FePSe3)制造,有助医生为病人订定最佳的成像模式和治疗方法,并促进具靶向性、高疗效及安全的新一代癌症诊疗一体化的发展。此外,该纳米片能显著改善肿瘤的治疗效果,减少副作用及提高病人存活率。
团队的研究成果已刊载於国际重要期刊Advanced Science。
协同治疗 — 结合免疫疗法与光热治疗
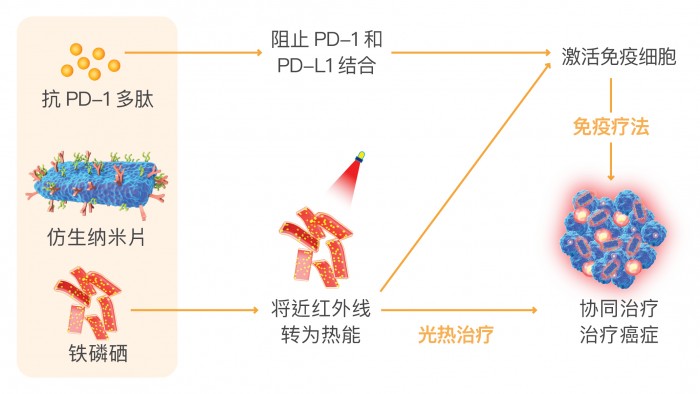
当癌细胞在病人体内增长时,身体的免疫系统会释放出一种称为T细胞的白血球来攻击肿瘤;癌细胞则释放出一种名为 PD-L1 的蛋白质来还击,PD-L1 会与T细胞上的 PD-1 结合,抑制免疫系统的活化能力,令T细胞不会攻击癌细胞。
研究人员於纳米片上加入称为抗PD-1 多肽的免疫药。当仿生纳米片被注射入病人体内后,它会移向癌细胞,然后把免疫药释出,阻止PD-1 和PD-L1 结合,使 T细胞发挥正常免疫功能。
该纳米片的表面面积宽阔,有利於提高免疫药的载药率,用药剂量因而可减低,并减少副作用,提高治疗效益。
由於铁磷硒具备良好的光热转换效能,可以在近红外镭射照射下产生大量热能,直接将肿瘤细胞杀死,因此该纳米片亦能达致光热疗法的效果,而当中所产生的热能可以进一步促进免疫治疗,阻止肿瘤增生。
仿生纳米片促成协同治疗
| 把免疫药送达癌细胞 由於人体免疫系统会攻击外来物产生排斥,研究人员便把纳米片以癌细胞膜包裹,使纳米片伪装成类近的癌细胞,利用物以类聚的原理,提高纳米片的靶向效能。当纳米片贴近肿瘤时,它外层的癌细胞膜便会黏附癌细胞,并从纳米片上脱落,而内里的纳米片便会释放出药剂进行免疫治疗。 |
治疗、诊断、疗效监控合而为一
该纳米片除促进协同治疗外,亦有助於诊断,这是由於铁磷硒具备磁、光、热等方面的特性,可促成多模态成像,包括核磁共振成像、光声成像和光热成像。铁磷硒的这些特性为研发诊疗一体化纳米材料,提供了实用的设计蓝本。
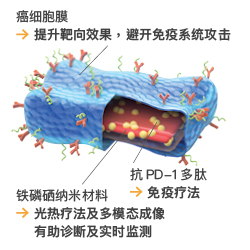
该纳米片具备多功能设计
此外,多模态成像亦有助於实时监察肿瘤的变化和治疗病变,例如:利用核磁共振成像观察纳米片在肿瘤囤聚的进展;以磁共振成像和光声成像追踪肿瘤的增长情况;以及利用光热成像监察升温状况。这些不同的治疗及成像方法,可让医生为病人建议最合适的治疗方案。
因此,该纳米片有望成为多模态诊断与协同治疗的 "多合一" 诊疗一体平台。
应用前景乐观
黄教授与团队在2018 年开始这项研究,他表示:"理大的生物及化学专家在药物研发方面一直不遗余力,尤其在抗癌药方面取得重大突破。这新型仿生纳米片正是理大致力抗癌治疗的另一项成果。"
研究团队将进一步探讨在其他癌症治疗上应用这种纳米材料的可能性,以及应用於长期治疗的效果,并研究其在生物体内的代谢情况,期望更多癌症病人可受惠於崭新的诊疗方法。